Gases
são fluidos no estado gasoso. A característica que os difere dos fluidos
líquidos é que, quando colocados em um recipiente, estes têm a capacidade de
ocupá-lo totalmente. A maior parte dos elementos químicos não-metálicos
conhecidos são encontrados no seu estado gasoso, em temperatura ambiente.
Gás perfeito ou ideal
É
considerado um gás perfeito quando são presentes as seguintes características:
- o movimento das moléculas é regido pelos princípios da mecânica Newtoniana;
- os choques entre as moléculas são perfeitamente elásticos, ou seja, a quantidade de movimento é conservada;
- não há atração e nem repulsão entre as moléculas;
- o volume de cada molécula é desprezível quando comparado com o volume total do gás.
Equação de Clapeyron
Esta
equação é chamada Equação de Clapeyron, em homenagem ao físico francês Paul
Emile Clapeyron que foi quem a estabeleceu.
Onde
n é o número de mols e R é a constante universal dos gases perfeitos. Essa
constante pode assumir os seguintes valores:
R = 0,082 atm.L/mol.K = 8,31 J/mol.K
A
expressão acima só é válida se considerarmos a temperatura absoluta, isto é, na
escala kelvin.
Equação geral dos gases perfeitos
Quando
o gás sofre uma transformação em que todas as variáveis de estado sofrem
mudança temos:
São
muito comuns as transformações em que ocorrem duas das variáveis de estado,
mantendo-se uma constante. Pode-se ter, então: isotérmica, ou isobárica ou
isovolumétrica.
Transformações gasosas
a) Isotérmica (Lei de Boyle-Mariotte)
A
temperatura permanece constante. Nessa transformação quando a temperatura é
constante, a pressão (P) exercida por certa massa gasosa é inversamente
proporcional ao volume (V) por ela ocupado, ou P.V = constante.
b) Isobárica (Lei de Gay-Lussac)
Ocorre
à pressão constante (iso = igual; barros = pressão). Foi observado que para uma
certa massa de gás perfeito, mantida a pressão constante, o volume é
diretamente proporcional à temperatura absoluta.
c) Isovolumétrica (Lei de Charles)
Nessa
transformação o volume é mantido constante (iso = igual; coros = volume). Ela também é conhecida como transformação isocórica ou isométrica. Ficou
comprovado que numa transformação isocórica, a pressão (P) é diretamente
proporcional à temperatura absoluta (T),
Como
a temperatura de um gás perfeito diminui à medida que a pressão também diminui,
então deveria existir uma temperatura muito baixa na qual a pressão seria nula,
obtida pelo prolongamento dos gráficos acima onde as retas representativas de
cada gás convergem para um único ponto: - 273,15 °C = 0 K, no qual a pressão
exercida pelos gases torna-se nula.
Por Thiago Miranda
Me. Prof. de Física

.png)

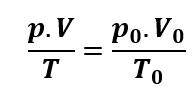



Comentários
Postar um comentário